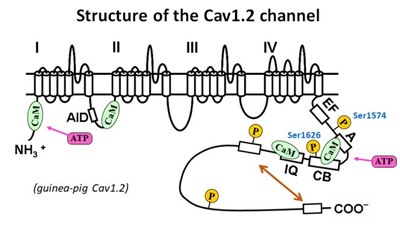
3.L宆Ca僠儍僱儖 (Cav1.2) 偺妶惈挷愡婡峔
| Ca僠儍僱儖偼丄嵶朎撪傊偺Ca2+偺棳擖検傪挷愡偟丄嵶朎偺嫽暠惈偵婑梌偟偰偄傑偡丅Ca僠儍僱儖帺懱傕嵶朎撪Ca2+擹搙偺憹尭偵傛傝妶惈偑曄摦偟傑偡丅巹偨偪偼丄僷僢僠僋儔儞僾朄傪梡偄偰Cav1.2僠儍僱儖偺挷愡偵娭傢傞嵶朎撪場巕偺 扵嶕偲偦偺惂屼婡峔偺夝柧傪恑傔偰偄傑偡丅 亂inside-out patch婰榐朄偵偮偄偰亃 Inside-out patch婰榐朄偲偼丄嵶朎偵枾拝偝偣偨(Cell-attached)揹嬌傪堷偒棧偟丄揹嬌愭抂偵僔乕儖偝傟偨嵶朎枌偵偁傞僠儍僱儖偺妶惈傪揹棳傪應掕偡傞偙偲偵傛傝夝愅偡傞曽朄偱偡丅Ca僠儍僱儖偺挷愡婡峔偼暋嶨偱偡丅Inside-out patch婰榐朄偼晅壛偡傞梟塼傪擟堄偵僐儞僩儘乕儖偱偒傞偨傔丄暋嶨側嵶朎撪娐嫬偐傜愗傝棧偟偨忬懺偱丄僠儍僱儖偺妶惈傪夝愅偱偒傞棙揰偑偁傝傑偡丅 |
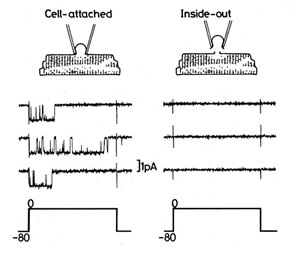 |
- 嘆 僇儖儌僕儏儕儞(CaM)偲ATP偑僠儍僱儖偺妶惈堐帩偵昁恵偱偁傞丅
- Cell-attached偐傜inside-out patch偵堏峴偡傞偲丄悢暘偺撪偵僠儍僱儖偺妶惈偼徚幐偟傑偡(run-down尰徾)丅巹偨偪偼丄CaM偲ATP傪晅壛偡傞偙偲偵傛傝丄僠儍僱儖偺妶惈偑inside-out mode偱傕堐帩偝傟傞偙偲傪尒弌偟傑偟偨(Xu et al., 2004)丅偮傑傝丄inside-out mode偱偼僠儍僱儖偐傜CaM偑夝棧偡傞偨傔偵妶惈偑幐傢傟傞偙偲偐傜丄CaM偼僠儍僱儖偺妶惈堐帩偵昁恵偺場巕偱偁傞偙偲偑帵嵈偝傟偨偺偱偡丅CaM偼丄嵶朎撪偵峆忢揑偵懚嵼偡傞Ca2+寢崌抈敀偱丄Ca僠儍僱儖偺懠偵傕條乆側抈敀幙偺妶惈挷愡偵娭傢傞偙偲偱抦傜傟偰偄傑偡丅偟偐偟丄Ca僠儍僱儖偺CaM偵傛傞惂屼婡峔偵偮偄偰偼枹夝柧偱偡丅
- 嘇 僇儖儌僕儏儕儞(CaM)擹搙埶懚惈偺僠儍僱儖挷愡婡彉偑偁傞丅
- Ca僠儍僱儖偵偼Ca2+擹搙埶懚惈偺妶惈壔(CDF)偲晄妶惈壔(CDI)偑偁傝傑偡偑丄巹偨偪偼inside-out mode偵偍偄偰丄Ca2+擹搙傪堦掕偺忦審偵偟偰傕丄CaM偺擹搙傪曄偊傞偙偲偵傛傝丄僠儍僱儖妶惈偑曄壔偡傞偙偲傪曬崘偟傑偟偨(Han et al., 2010)丅偙偺Ca2+擹搙旕埶懚惈偺妶惈曄壔偼CaM擹搙偵埶懚偟偨挷愡婡峔偑偁傞偙偲傪帵嵈偟偰偄傑偡丅Pull down幚尡偺寢壥偐傜丄僠儍僱儖1暘巕偵2暘巕偺僇儖儌僕儏儕儞偑寢崌偡傞偙偲偑帵嵈偝傟傑偟偨(Minobe et al., 2011)丅偦偙偱廬棃偺侾暘巕偺CaM偵傛傞僠儍僱儖偺惂屼儌僨儖偵懳偟偰丄怴偨偵2CaM寢崌儌僨儖傪採彞偟傑偟偨 (Han et al., 2010)丅掅擹搙Ca2+偱1偮偺CaM偑僠儍僱儖偺妶惈壔晹埵偵嶌梡偟丄崅擹搙Ca2+偱偼偝傜偵暿偺CaM偑僠儍僱儖偺晄妶惈壔晹埵偵嶌梡偡傞偲偄偆壖愢偱偡丅
- 嘊 僇儖儌僕儏儕儞(CaM)偵傛傞僠儍僱儖妶惈壔偺寢崌晹埵偼IQ僪儊僀儞偱偁傞丅
- CaM偺傎偐偵丄僇儖僷僗僞僠儞偺L僪儊僀儞(CSL)偑僠儍僱儖傪妶惈壔偡傞嶌梡傪帩偮偙偲傪曬崘偟傑偟偨(Minobe et al. 2006)丅CaM偲CSL傪僠儍僱儖偵摨帪偵晅壛偡傞偲丄CSL偼CaM偺partial agonist偲偟偰嶌梡偡傞偙偲偑柧傜偐偵側傝傑偟偨(Minobe et al. 2011)丅Pull down幚尡偺寢壥偐傜丄CaM偲CSL偼嫞崌揑偵僠儍僱儖偺C枛抂晹偵偁傞IQ僪儊僀儞偵寢崌偡傞偨傔丄IQ僪儊僀儞偑僠儍僱儖妶惈壔偺愑擟晹埵偱偁傞偙偲偑帵嵈偝傟傑偟偨丅
- 嘋 A僉僫乕僛(PKA)偵傛傞僠儍僱儖妶惈壔偺儕儞巁壔晹埵偼1574僙儕儞偱偁傞丅
- PKA偼丄僠儍僱儖傪儕儞巁壔偟懀捠嶌梡傪帵偟傑偡偑丄偦偺愑擟晹埵偼摨掕偝傟偰偄傑偣傫丅僠儍僱儖偺PKA儕儞巁壔攝楍偵曄堎傪摫擖偟丄cell-attached mode偱Forskolin(傾僨僯儖巁僔僋儔乕僛傪妶惈壔偟cAMP擹搙傪忋偘傞丅)偺岠壥傪挷傋傑偟偨丅偦偺寢壥丄1574僙儕儞偲1626僙儕儞偑僠儍僱儖偺懀捠偵廳梫偱偁傞偙偲偑柧傜偐偵側傝傑偟偨(Minobe et al., 2014)丅
- 嘍 僠儍僱儖偺C枛抂攝楍偺帺屓梷惂婡彉偺夝柧
- 僠儍僱儖偺C枛抂攝楍偼帺屓梷惂嶌梡偑偁傞偙偲偑曬崘偝傟偰偄傑偡丅C枛抂攝楍傪寚懝偝偣偨曄堎懱(Minobe et al., 2017)傗C枛抂攝楍儁僾僠僪傪梡偄偨幚尡偵傛傝偦偺暘巕婡峔傪柧傜偐偵偟傑偡丅
| 偙偺傛偆偵僠儍僱儖偺妶惈惂屼偵偼條乆側場巕偑娭梌偡傞偨傔丄 巹偨偪偼CaM傪庡場巕偲偟偰丄ATP傗僉僫乕僛偺嶌梡偵壛偊丄 Ca2+擹搙傗pH曄壔偺嶌梡側偳嵶朎撪偺娐嫬傪峫椂偟丄 暋崌揑偵僠儍僱儖偺妶惈挷愡婡峔傪偲傜偊傞偙偲傪栚巜偟偰 偄傑偡丅 |
 |
- 尋媶撪梕
- 戝擼恄宱僱僢僩儚乕僋峔抸偵偍偗傞恄宱妶摦偺栶妱
- 戝擼恄宱嵶朎偺嫽暠惈妉摼偺儊僇僯僘儉偲幘姵
- L宆Ca僠儍僱儖 (Cav1.2) 偺妶惈挷愡婡峔



